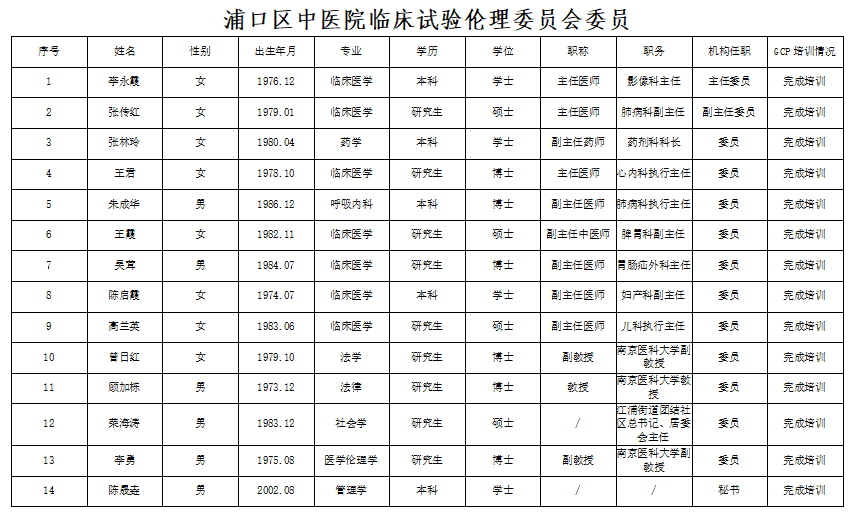
南京市浦口区中医院临床试验伦理委员会成立于2025年3月28日,现已通过国家全民健康保障信息平台备案系统完成备案。本院临床试验伦理委员会由从事医药相关专业人员、伦理学专家、法律专家以及社区代表组成,符合国家药品监督管理局《药物临床试验质量管理规范》《药物临床试验伦理审查工作指导原则》和国家卫生健康委员会《涉及人的生命科学和医学研究伦理审查办法》中关于伦理委员会委员组成的要求。本委员会共有委员13名,其中设主任委员1名,副主任委员1名,另设专职秘书1名,委员及秘书均经过GCP及伦理相关知识的培训。
本院临床试验伦理委员会设独立的办公室和档案室,办公设施齐备,能够满足伦理审查工作的需要。临床试验伦理委员会秘书负责临床试验伦理委员会日常行政事务的管理工作。临床试验伦理委员会主要工作任务是对项目的科学性和伦理合理性进行独立和及时的审查,并根据伦理审查工作的需要,不断完善管理和制度体系建设,不断修订相关管理制度、审查申请指南和标准操作规程,旨在保证受试者尊严、安全和权益,促进临床试验科学、健康地发展,增强公众对药物临床试验的信任和支持。档案室做到防火、防盗、防潮、防虫、防鼠,项目档案专柜管理,按文件编号分类存放。每个项目档案按照审查材料和备案材料两类分盒存放。此外,将伦理档案材料按照结题项目、在研项目与待审项目分柜存放。
临床试验伦理委员会工作职责为根据伦理审查工作需要不断完善组织管理和制度建设,履行保护受试者的安全和权益的职责;伦理委员会制定制度、指南和标准操作规程,以确保伦理审查工作的规范性与一致性;伦理委员会对涉及人的生物医学药物临床试验项目的科学性和伦理合理性进行独立、公正、公平和及时的审查;伦理委员会对委员以及工作人员的继续教育建立培训机制,制订培训计划,组织GCP等相关法律法规、药物临床试验伦理审查技术以及伦理委员会标准操作规程的培训;伦理委员会应向省级药品监督管理局报告年度伦理审查工作情况;临床试验伦理委员会秘书负责伦理委员会日常行政事务的管理工作。
临床试验伦理委员会的审查范围为药物临床试验项目。审查类别包括初始审查、跟踪审查和复审。审查方式为会议审查、快速审查和紧急会议审查。
临床试验伦理委员会计划每月召开一次审查会议,对药物临床试验项目进行初始审查(审查的主要内容包括:评估试验方案的设计与实施、试验的风险与受益、受试者招募、知情同意书告知信息、知情同意过程、受试者的医疗和保护、隐私和保密、涉及弱势群体的试验等)和跟踪审查(审查的主要内容包括:修正案审查、研究进展审查、严重不良事件审查、违背方案审查、暂停/终止研究审查、结题审查)。
总之,本院临床试验伦理委员会将在工作过程中加强学习与培训,加强交流与合作,逐步与国际接轨,不断提高临床试验伦理委员会的审查能力、审查质量及管理水平,更好地推进中国医学伦理的发展。